Ihr Standort:Home > Registrierung importierter Arzneimittel
一、 Registration Kategorien und Angaben
(一) Registration Kategorien 1.Wirkstoffe und deren Präparate extrahiert aus Pflanzen, Tieren und Mineralien, die in China nicht vermarktet werden.
2.Neu entdeckte Droge Material und Fertigpräparate
3.Die neue chinesische Kräuter ersetzt
4.Neuen Teil der Droge Material als Drogen verwendet werden
5.Neue aktive Teil des Materials als Drogen und deren Präparate, die aus Pflanzen, Tieren und Mineralien gewonnen werden und nicht in China vermarktet werden
6.Traditionelle chinesische Medizin, Natürliche Medizin, Ihre Kombinationspräparate in China noch nicht vermarktet.
7.Präparate mit geänderter Applikationsweg des TCM oder natürliche Drogen bereits in China vermarktet werden,
8.Präparate mit Veränderung der Dosierung Form der TCM oder natürliche Drogen bereits in China vermarktet
9.Generika
(二)Angabe
1.Registrierung Kategorie 1:Wirkstoffe und deren Vorbereitung extrahiert aus Pflanzen, Tieren und Mineralien, die in China nicht den Verkehr gebracht worden(beziehen sich auf die einzelne Komponente oder deren Präparate, die aus Pflanzen, Tieren und Mineralien gewonnen werden und noch nicht in der Nationale Drogen-Standards, wobei der Gehalt an diesem einzigen Komponente mehr als 90% der Extraktion werden sollten gesammelt)
2.Registrierung Kategorie 2: Neu entdeckte Droge Material und Präparate(beziehen sich auf das Droge Material und Präparate noch nicht in National Droge Standard-oder Provinzebene Droge Material Formelsammlung (gesetzliche Normen) gesammelt)
3.Registrierung Kategorie 3:Die neue chinesische Kräuter ersetzt
4.Registrierung Kategorie4:Neuen Teil der Droge Material als Drogen verwendet werden(beziehen sich auf den neuen Teil der bestehenden Medikamente von Tieren oder Pflanzen, die als Medikament eingesetzt werden soll, während die vorhandenen Medikamenten ist bereits in der gesetzlichen Standards)
5.Registrierung Kategorie5: Neue aktive Teil des Materials und deren Präparate, die aus Pflanzen, Tieren und Mineralien gewonnen werden und nicht in China vermarktet werden(beziehen sich auf aktive Teile von eine oder mehrere Komponenten und deren Präparate, die aus Pflanzen, Tieren und Mineralien, dan noch nicht in der Nationale Drogen-Standards, in denen der aktive Teil mehr als 50% der Extraktion sein sollte)
6.Registrierung Kategorie6: Traditionelle chinesische Medizin, Natürliche Medizin, Ihre Kombinationspräparate in China noch nicht vermarktet. Einbeziehen
6.1 Kombinationspräparate von der TCM
6.2 Kombinationspräparate von der Natürliche Medizin
6.3 Kombinationspräparate von TCM, natürliche Medikamente und chemische Drogen
kombinierte Herstellung von TCM sollte unter der traditionellen chinesischen medizinischen Theorie formuliert werden, einschließlich kombinierte Herstellung von TCM aus dem alten klassischen Formel, Kombipräparat mit Indikation der alten Begriff oder Kombipräparat mit kombinierten Begriff.
kombinierte Herstellung von natürlichen Drogen sollte unter modernen medizinischen Theorie, seine Indikation sollte in der modernen medizinischen Begriff formuliert werden. kombinierte Herstellung von TCM, natürliche Drogen und chemische Drogen gehören Herstellung von TCM und chemischen Drogen, kombiniert Herstellung von natürlichen Drogen und chemischen Drogen, und kombinierte Herstellung von TCM, natürliche Drogen und chemische Drogen kombiniert
7.Registrierung Kategorie7:Präparate mit Änderungen in Art der Verabreichung des TCM oder natürliche Drogen bereits in China vermarktet werden, (beziehen sich auf die Zubereitung Wechsel zwischen Art der Verabreichung oder Absorption Lage)
8.Registrierung Kategorie8: Präparate mit Veränderung der Dosierung Form der TCM oder natürliche Drogen bereits in China vermarktet (beziehen sich auf die Veränderung der Formulierung , aber ohne Veränderung der Art der Verabreichung.)
9.Registrierung Kategorie9: Generika (beziehen sich auf die Registrierung der TCM oder natürliche Drogen, die bereits zugelassen in China vermarktet werden)
二. Antrag Informationen Artikel und Notizen
(一) Antrag Information Artikel
Zusammenfassende Informationen
1.Name der Arzneimittel
2.Zertifizierte Dokumente
3.Grundlage und Anwendungszweck des Thema
4.Zusammenfassung und Bewertung der wichtigsten Forschungsergebnisse,
5.Entwurf der Packungsbeilage, Anmerkungen zum Entwurf und neueste Literatur
6.Probe-Design für die Verpackung, Etikett.
Pharmazeutische Forschung Daten
7.Zusammenfassung der pharmazeutischen Studieninformationen.
8.Quelle der Droge Material, die Grundlage der Identifikation
9.Ökologische Umwelt, Identität, Beschreibung, Anbau, und Anbautechnik, lokale Verarbeitung und Herstellung der Drogen Material
10.Entwurf der Norm von Drogen Material und die Angabe von Entwurf, Drogen Standard -Stoffe und einsclägigen Informationen
11.Die Präparate pflanzlichen , mineralischen oder pflanzlichen Proben umfassen Blüte, Frucht und Samen
12.Forschungsinformation, Prozessvalidierungsdaten und Literatur der Produktiontechnologie , Quelle und Qualitätsstandards der Hilfsstoffe.
13.Experiment Daten und Literatur von Chemische Bestandteile Studie
14.Experiment Daten und Literatur von Qualität Studie
15.Entwurf der Norm von Drogen und die Angabe von Entwurf, Drogen Standard -Stoffe und einsclägigen Informationen
16.Selbst Prüfbericht
17.Experiment Daten und Literatur von Droge Stabilität
18.Grundlage für die Auswahl und Qualität Standard der unmittelbaren Verpackung und Behälter
Pharmakologie und Toxikologie Studieninformationen
19.Zusammenfassung über die Pharmakologie und Toxikologie-Studie Informationen.
20.Experiment Daten und Literatur von Pharmakodynamik
21.Experiment Daten und Literatur von Pharmakologie
22.Experiment Daten und Literatur von akute Toxizität
23.Experiment Daten und Literatur von dauernde Toxizität
24.Spezielle Sicherheitshinweise und Literatur der Überempfindlichkeit (topische, systemische und Foto-Toxizität), hämolytische und topische Stimulieren (Blutgefäß, Haut-, Schleimhaut-und Muskel-) und die Abhängikeit, Reaktion auf lokale und systemische Verwendung der Drogen.
25.Experiment Daten und Literatur von der Genotoxizität
26. Experiment Daten und Literatur von Zeugungtoxizität
27.Experiment Daten und Literatur von Karzinogenität,
28.Experiment Daten und Literatur von Animal Pharmakokinetik Klinik Studieinformation
29.Zusamenfassung der Klinik Studieinformation
30. Pläne und Programme für klinische Studien.
31.Handbuch der Klinikforschung
32Musterentwurf Einwilligungserklärung, Genehmigung der Ethikkommission.
33.Zusammenfassung des Berichts über die klinische Studie
(二)Notizen
1.Angabe der Antrag Information
Zusammenfassende Informationen
1.Information Artikel 1 Name der Arzneimittel
1) Chinesische Name
2) Phonetische Namen
3) Begründung der Benenung
2. Information Artikel 2 Zertifizierte Dokumente
1) Der Nachweis der amtlichen Eintragung der Antragstellenden,Herstellungserlaubnis der Arzneimittel, GMPZertifikate, Kopie von Beglaubigen
2) Zertifizierte Dokumente Angabe Patent-Status und Eigentümer Status von der Technologie, Anwendungszweck und Rezept der Arzneimittel, und die Eklärung , dass es keine Verletzung von Patentrechten der Andere gibt.
3) Kopien der behördlichen Genehmigungen des Forschungsvorhabens von Betäubungsmitteln, psychotropen, medizinisch-Verwendung toxischer und radioaktiver Medikamente
4) Für den Antrag der Produktion neuer Medikamente,soll Kopie der Genehmigung der klinischen Studie der Neu vorgelegt werden.
5) Import Drug Verpackungsmaterial und Container-Zertifikat für die unmittelbare Verpackung und Behälter ( Kopie)
6) Andere Dokumente
Wenn es der Einfuhr ist, werden die folgenden ebenfalls erforderlich:
1) Zertifizierte Dokumente, beglaubigte Dokument der Zulassung für der Arzneimittel Inverkehrbringen, ausgestellt von den zuständigen Behörden des jeweiligen Landes oder Region, wo der Hersteller befindet.Ausfuhrerlaubnis ausgestellt von den zuständigen Behörde
2) Wenn durch ein Agentur in China beantragen, soll die Vollmacht, beglaubigte Dokument und Kopie von Geschäftslizenz des Unternehmens
3) Aus Sicherheitsgründen Experiment Daten sollten Sie GLP-Zertifikat versehen werden GMP-Zertifikat der Proben von klinischen Studien zur Verfügung gestellt werden 3. Information Artikel 3 Grundlage und Anwendungszweck des Thema
Alte und moderne Literatur sollte für TCM und natürliche Arzneimittel zur Verfügung gestellt werden. Quelle der Formel und Grundlage für die Anwendung, aktuelle Entwicklung、 Forschung Situation und Herstellung in China und in Übersee, aktuelle klinische Verwendung und Herstellung Zusammenfassend erforderlichen Analysen für die Innovation, Machbarkeit und Zweckmäßigkeit Darreichungsform, einschließlich der Vergleich mit ähnlichen Medikament bereits mit den nationalen Standard, sollte für die Herstellung von TCM und natürliche Arzneimittel bereitgestellt werden. Für TCM traditionelle medizinische Theorie und alte Droge Buch sollte auch vorgesehen sein.
4.Information Artikel 4 Zusammenfassung und Bewertung der wichtigste Forschungsergebnisse, Schließt Zusammenfassung der wichtigsten Forschungsergebnisse durch den Antragsteller und eine umfassende Analyse der Sicherheit, Wirksamkeit und Qualität Steuerbarkeit der Arzneimittel.
5.Information Artikel 5 Entwurf der Packungsbeilage, Anmerkungen zum Entwurf und neueste Literatur umfasst die Entwurf der Packungsbeilage in Übereinstimmung mit den einschlägigen Vorschriften eingezogen, Notizen, wie die einzelnen Elemente der Packungsbeilage eingezogen worden waren, neuesten relevanten Literatur über die Sicherheit und Wirksamkeit Pharmazeutische Forschung Daten
6. Information Artikel 16 Selbstprüfung beziehen sich auf den Selbsttest Bericht der Probe, Bericht für mindestens einer Charge sollte zum Zeitpunkt der Beantragung der klinischen Studie, nach Abschluss der klinischen Studie, Selbsttest Bericht von der Kontinuierliche drei Chargen bei der Vorlage der Unterlagen. Pharmakologie und Toxikologie Studieninformationen
7. Information Artikel 24 Spezielle Sicherheitshinweise und Literatur der Überempfindlichkeit (topische, systemische und Foto-Toxizität), hämolytische und topische Stimulieren (Blutgefäß, Haut-, Schleimhaut-und Muskel-) und die Abhängikeit, Reaktion auf lokale und systemische Verwendung der Drogen. Experimente Informationen über die Sicherheit der Zubereitung sollte nach den Angaben der Art der Verabreichung und Zubereitung bereitgestellt werden. Wann gibt es eine Tendenz der Drogenabhängigkeit sollte Experiment Daten im Zusammenhang mit der Drogenabhängigkeit zur Verfügung gestellt werden
8. Information Artikel 25 Experiment Daten und Literatur von der Genotoxizität wenn die Medikament Material beinhalten noch nicht in der gesetzlichen Normen Droge gesammelt oder aus dem aktiven Teil der Droge Material noch nicht in der gesetzlichen Normen oder eine neue Droge gesammelt, um Bevölkerung im gebärfähigen Alter, wo sie wirken auf Zeugungssystem verwendet werden (z. als Verhütungsmittel, Sexualhormone, Drogen zum Zwecke der sexuellen Funktionsstörung, die Förderung der Drogen für die Reifung von Spermien, die neuen Medikamente mit positivem Ergebnis im Test Mutationen oder Drogen mit Zytotoxizität), sollte Genotoxizität Testdaten zur Verfügung gestellt.
9. Information Artikel 26 Experiment Daten und Literatur von Zeugungtoxizität
für neue Arzneimittel für die Patienten im gebärfähigen Gruppe, wo er im Bereich der Zeugungssystem wirken können (z. B. Kontrazeptiva, Sexualhormone, Drogen zum Zwecke der sexuellen Funktionsstörung, Drogen für die Reifung der Förderung von Spermien, die neuen Medikamente mit positivem Ergebnis im Test Mutationen oder verwendet werden Medikamente mit Zytotoxizität), sollte Zeugungtoxizität Testdaten nach der spezifischen Situation zur Verfügung gestellt
10. Information Artikel 27 Experiment Daten und Literatur von Karzinogenität,
bei dauernde Toxizität eines neuen Medikaments, wenn zytotoxischen Effekte gezeigt wurden oder außerordentliche Aktivierung auf das Wachstum von Zellen in bestimmten inneren Organen und Geweben verursacht wurden, oder es ist ein positives Testergebnis während Mutagenitätstest, dann Experimente Informationen und Literatur zu Karzinogenität müssen zur Verfügung gestellt.
(二) Anforderungen für Antragsunterlage
1. Information Artikel 1-4 und 7-31 sollten in der Regel zur Anwendung für klinische Studien neuer Medikamente vorgelegt werden.
2. Für Antrag der Arzneimittel Produktion nach Abschluss der klinischen Prüfung, Information Artikel 1-33 sowie sonstige Änderungen sowie zusätzliche Informationen sollten mit ausführlicher Erklärung der Gründe und Grundlagen für den Veränderung vorgelegt werden
3. Information Artikel 2-8, 12 und 15-18 sollten in der Regel für den Einsatz von Generika (außer für TCM oder natürliche Droge Injektion wo klinische Studie ist erforderlich) eingereicht werden.
4. Alle technischen Informationen und beglaubigte Dokument von der lokalen Behörde für die Einfuhrsantrag verwendet werden soll in der chinesischen mit Originaldokument. Chinesische Version von Qualitätsstandards sollten entsprechend dem Format des chinesischen Nationalen Drogen-Standards geordnet und eingereicht werden
5. Wie für die Komplexität und Vielfalt der TCM und natürlichen Drogen, Sollte mit den Eigenschaften bestimmter Sorten der erforderlichen Studien kombiniert werden. Wenn es notwendig Ermäßigung oder Befreiung von Tests,das genügend Gründe gerechtfertigt werden sollte
6. Technischen Anforderungen der TCM und natürliche Droge Injektion gesondert formuliert werden
7. Die erforderlichen Informationen für die unter "Registrierung Kategorie 1" Wirkstoffe und deren Vorbereitung extrahiert aus Pflanzen, Tieren und Mineralien, die nicht in China vermarktet werden, wenn der Wirkstoff oder seine Metaboliten mit den bekannten krebserzeugenden Stoffen oder ähnlichen sind, wenn der erwartete Behandlungsdauer ist länger als 6 Monate, oder die Behandlung der chronisch rezidivierenden Erkrankungen und Intermittierende Gebrauch von Drogen, dann Experimente Informationen und Literatur zu Karzinogenität vorzusehen.
Für die Wirkstoffen und deren Vorbereitung extrahiert aus Pflanzen, Tieren und Mineralien, die in China nicht in den Verkehr gebracht worden, wenn die ähnlich wie Medikament oder eine Zubereitung aus dem aktiven Teil von einzelnen Pflanzen, Tieren und Mineralien gewonnen , die in China vermarktet worden, sind , seiner aktiver Teil sollte mit dem andere über Pharmakodynamik und anderen Aspekten Vergleicht werden,um Vorteilen und Eigenschaften zu zeigen
8. Für den Ersatz der TCM Material unter der Registrierung Kategorie 3, zusätzlich zu den vorklinischen Vorlage Erfordernis der Kategorie 2, soll der Versuch Daten von Pharmakodynamik Vergleich zwischen diesem Medikament und der substituierten Medikament auch vorgesehen werden, Information der menschlichen Toleranz Test-und klinischen Bioäquivalenz Test der damit zusammenhängenden Vorbereitungs sollte auch vorgesehen werden. Wenn der Ersatz ist ein einkomponentiger, Experiment Daten und Literatur der pharmakokinetischen Test vorlegen werden sollen.
Die neue chinesische Kräuter ersetzt genehmigt, die Präparate mit ersetzte Kraüte ,Antrag sollte das Verfahren der ergänzenden Anwendung , aber unbedingt an eine zugelassene Alternative im Bereich der Funktionen beschränkt.
9. Die erforderlichen Informationen für die unter "Registrierung Kategorie 5" Wirkstoffe und deren Vorbereitung extrahiert aus Pflanzen, Tieren und Mineralien, die nicht in China vermarktet werden,zusätzlich zu den erforderlichen Informationen Anwendung, sind auch die folgenden Informationen benötigt, um vorgelegt werden,
1) Forschung Informationen oder Literatur, die Auswahl der aktiven Teile, von Information Artikel 12 erforderlich, Forschungs-Informationen und Literatur zu wichtigen chemischen Inhalt der aktiven Teile von Information Artikel 13 erforderlich.
2) Wenn die aktiven Teile aus mehreren Komponenten besteht, sollte der Gehalt jeder Komponenten untersucht werden, und es sollte untere Grenze der repräsentativen Wert für jede Komponenten (Obergrenze sollte für die toxische Komponente ebenfalls hinzugefügt werden.
3) Bei dem Antrag um neue aktive Teil und deren Vorbereitung, die mit ähnlichem Inhalt zusammengefasst und extrahiert aus Pflanzen, Tieren und Mineralien und nicht in China vermarktet werden, wenn das enthaltende aktiver Teil aus Pflanzen, Tieren und Mineralien extrahiert und in China vermarktet werden, die sollte mit andere über Pharmakodynamik und anderen Aspekten Vergleicht werden,um Vorteilen und Eigenschaften zu zeigen
10. Die erforderlichen Informationen für die unter "Registrierung Kategorie 6", Traditionelle chinesische Medizin, Natürliche Medizin, Ihre Kombinationspräparate in China noch nicht vermarktet für verschiedene Situation sind:
1) Kombinierte Herstellung von TCM, einige Experiment Daten können nach dem Ursprung der Formel, Anzeige-und Herstellungsverfahren befreit werden
2) Experiment Daten und Literatur der Wirksamkeit und der Interaktion mehrerer Komponente sollte für natürlichen Medizin zur Verfügung gestellt
3) Wenn die Rezeptur ehtahltet die Arzneistoffe,die nicht in dem gesetzlichen Arzneimittel -Standard sind,zusätzliche Informationen sind erforderlich, um gemäß den Anforderungen der entsprechenden Eintragung Kategorie eingereicht werden.
4) Es muss eine gesetzliche Standards für jedes Material von Arzneimittel haben, die in der kombinierten Herstellung von TCM, natürliche Drogen und chemische Medikamente eingesetzt.Vergleichsversuch Daten und Literatur im Hinblick auf Wirksamkeit und Interaktion (Verbesserung der Wirksamkeit, Toxizität reduzieren oder Komplimente) zwischen TCM ,natürliche Drogen und chemischen Drogen, sowie Experiment Daten ,die TCM, natürliche Drogen auf die Bioverfügbarkeit von chemischen Drogen, die Beide sollten für die Anwendung von klinischen Studien zur Verfügung gestellt. Bei dem Antrag für die Produktion, Informationen aus klinischen Studie sollte der Nachweis der Notwendigkeit der Rezeptur und die experimentellen Daten der Interaktion in der Bio-Verfügbarkeit zwischen TCM, natürliche Drogen und chemische Medikamente zur Verfügung gestellt werden sollten. Chemische Drogen, die in der Rezeptur(einzeln oder kombiniert Rezepture) verwendet werden, müssen in der National Droge Standards gesammelt wurden.
11. für die unter "Registrierung Kategorie 8", dass das Präparat mit Veränderung der Formulierungen der TCM oder natürliche Drogen bereits in China vermarktet werden, die Vorteile und Vorzüge des neuen Präparat sollte erklärt werden,. Die Indikationen des neuen Präparat sollte grundsätzlich gleiche mit dem alten Präparat ist, wenn es keine Möglichkeit, von der Wirksamkeit oder klinischen Studie zu verifizierung, die entsprechenden Informationen bereitgestellt werden.
12. Für die unter "Registrierung Kategorie 9", sollten Generika mit dem originalen Arzneimittel übereinstimmen, wenn das nötig war, die Qualitätsstandards verbessert werden sollte.
13. Für klinische Studien
1) Fälle von Patienten für klinische Studien sollten den statistischen Bedarf und die erfoderliche minimale Fällen entsprchen
2) Die minimale Fällen erforderlich (Versuchsgruppe) von klinischen Prüfungen sind wie folgt, 20-30 für die Phase I, 100 für die Phase II, 300 für die Phase III, 2000 für die Phase IV
3) Das neue Arzneimittel gehört zu der Kategorie 1, 2, 4, 5 und 6, sowie die Arzneimittel der Kategorie 7 und die Drogen, die bedeutende Änderungen in der Technologie oder des Solvens hat,sollte Phase IV durchgeführt werden.
4) Fälle für Bioverfügbarkeit sollte normal 18-24 sein.
5) Phase I der klinischen Studie des Verhütungsmittel sollten nach dieser Verordnung durchgeführt. In Phase II-Studie sollte eine randomisierte, kontrollierte klinische Studie über mindestens 100 Paare von Probanden für mindestens 6 Zyklen Menstruation durchgeführt werden. In Phase-III-Studie sollte ein offener Prozess auf mindestens 1000 Fällen für 12 Menstruation Zyklen durchgeführt werden. In Phase IV-Studie sollte variable Faktoren diese Drogen sorgfältig geprüft werden, um die Studie mit einer ausreichenden Anzahl von Fällen zu beenden.
6) Die funktionelle Ersatz von neue TCM ersetzte Stoff,sollte TCM aus nationale Drogen-Standard auswählen, die geliche Wirksamkeit wie ersetzte TCM hat, als Vergleiche für vergleichende Studie verwendet, für jede Indikation, sollte mehr als 2 TCM Vorbereitungen für die Überprüfung und klinischen Fällen für jede Zubereitung verwendet werden, sollten nicht weniger als 100 Paaren sein.
7) Für diejenigen, die Veränderung der Formulierungen kann die klinische Prüfung freigestellt werden oder auf nicht weniger als 100 Paare der Fälle nach der Änderung der Verfahren und besondere Eigenschaft der Arzneimittel durchgeführt werden.
8) Für Generika, müssen die klinische Prüfung auf nicht weniger als 100 Paare von Fällen nach bestimmten Situation durchgeführt werden
9) Für importierte TCM oder natürliche Drogen, sollte Antragsunterlagen nach den entsprechenden Anforderungen der Registrierung Kategorie vorgesehen werden, die klinische Daten und Informationen des menschlichen pharmakokinetischen Studie in China durchgeführt vorgesehen sein sollte, mit nicht weniger als 100 Paare von klinischen Fällen. Für mehrere Indikationen, sollten klinische Fälle für jeden wichtigen Indikation nicht weniger als 60 Paare.
三. Tabelle des Antrag Information Artikel und Notizen
(一) Tabelle des Antrag Information Artikel für TCM und natürlichen Drogen
(一) Registration Kategorien 1.Wirkstoffe und deren Präparate extrahiert aus Pflanzen, Tieren und Mineralien, die in China nicht vermarktet werden.
2.Neu entdeckte Droge Material und Fertigpräparate
3.Die neue chinesische Kräuter ersetzt
4.Neuen Teil der Droge Material als Drogen verwendet werden
5.Neue aktive Teil des Materials als Drogen und deren Präparate, die aus Pflanzen, Tieren und Mineralien gewonnen werden und nicht in China vermarktet werden
6.Traditionelle chinesische Medizin, Natürliche Medizin, Ihre Kombinationspräparate in China noch nicht vermarktet.
7.Präparate mit geänderter Applikationsweg des TCM oder natürliche Drogen bereits in China vermarktet werden,
8.Präparate mit Veränderung der Dosierung Form der TCM oder natürliche Drogen bereits in China vermarktet
9.Generika
(二)Angabe
1.Registrierung Kategorie 1:Wirkstoffe und deren Vorbereitung extrahiert aus Pflanzen, Tieren und Mineralien, die in China nicht den Verkehr gebracht worden(beziehen sich auf die einzelne Komponente oder deren Präparate, die aus Pflanzen, Tieren und Mineralien gewonnen werden und noch nicht in der Nationale Drogen-Standards, wobei der Gehalt an diesem einzigen Komponente mehr als 90% der Extraktion werden sollten gesammelt)
2.Registrierung Kategorie 2: Neu entdeckte Droge Material und Präparate(beziehen sich auf das Droge Material und Präparate noch nicht in National Droge Standard-oder Provinzebene Droge Material Formelsammlung (gesetzliche Normen) gesammelt)
3.Registrierung Kategorie 3:Die neue chinesische Kräuter ersetzt
4.Registrierung Kategorie4:Neuen Teil der Droge Material als Drogen verwendet werden(beziehen sich auf den neuen Teil der bestehenden Medikamente von Tieren oder Pflanzen, die als Medikament eingesetzt werden soll, während die vorhandenen Medikamenten ist bereits in der gesetzlichen Standards)
5.Registrierung Kategorie5: Neue aktive Teil des Materials und deren Präparate, die aus Pflanzen, Tieren und Mineralien gewonnen werden und nicht in China vermarktet werden(beziehen sich auf aktive Teile von eine oder mehrere Komponenten und deren Präparate, die aus Pflanzen, Tieren und Mineralien, dan noch nicht in der Nationale Drogen-Standards, in denen der aktive Teil mehr als 50% der Extraktion sein sollte)
6.Registrierung Kategorie6: Traditionelle chinesische Medizin, Natürliche Medizin, Ihre Kombinationspräparate in China noch nicht vermarktet. Einbeziehen
6.1 Kombinationspräparate von der TCM
6.2 Kombinationspräparate von der Natürliche Medizin
6.3 Kombinationspräparate von TCM, natürliche Medikamente und chemische Drogen
kombinierte Herstellung von TCM sollte unter der traditionellen chinesischen medizinischen Theorie formuliert werden, einschließlich kombinierte Herstellung von TCM aus dem alten klassischen Formel, Kombipräparat mit Indikation der alten Begriff oder Kombipräparat mit kombinierten Begriff.
kombinierte Herstellung von natürlichen Drogen sollte unter modernen medizinischen Theorie, seine Indikation sollte in der modernen medizinischen Begriff formuliert werden. kombinierte Herstellung von TCM, natürliche Drogen und chemische Drogen gehören Herstellung von TCM und chemischen Drogen, kombiniert Herstellung von natürlichen Drogen und chemischen Drogen, und kombinierte Herstellung von TCM, natürliche Drogen und chemische Drogen kombiniert
7.Registrierung Kategorie7:Präparate mit Änderungen in Art der Verabreichung des TCM oder natürliche Drogen bereits in China vermarktet werden, (beziehen sich auf die Zubereitung Wechsel zwischen Art der Verabreichung oder Absorption Lage)
8.Registrierung Kategorie8: Präparate mit Veränderung der Dosierung Form der TCM oder natürliche Drogen bereits in China vermarktet (beziehen sich auf die Veränderung der Formulierung , aber ohne Veränderung der Art der Verabreichung.)
9.Registrierung Kategorie9: Generika (beziehen sich auf die Registrierung der TCM oder natürliche Drogen, die bereits zugelassen in China vermarktet werden)
二. Antrag Informationen Artikel und Notizen
(一) Antrag Information Artikel
Zusammenfassende Informationen
1.Name der Arzneimittel
2.Zertifizierte Dokumente
3.Grundlage und Anwendungszweck des Thema
4.Zusammenfassung und Bewertung der wichtigsten Forschungsergebnisse,
5.Entwurf der Packungsbeilage, Anmerkungen zum Entwurf und neueste Literatur
6.Probe-Design für die Verpackung, Etikett.
Pharmazeutische Forschung Daten
7.Zusammenfassung der pharmazeutischen Studieninformationen.
8.Quelle der Droge Material, die Grundlage der Identifikation
9.Ökologische Umwelt, Identität, Beschreibung, Anbau, und Anbautechnik, lokale Verarbeitung und Herstellung der Drogen Material
10.Entwurf der Norm von Drogen Material und die Angabe von Entwurf, Drogen Standard -Stoffe und einsclägigen Informationen
11.Die Präparate pflanzlichen , mineralischen oder pflanzlichen Proben umfassen Blüte, Frucht und Samen
12.Forschungsinformation, Prozessvalidierungsdaten und Literatur der Produktiontechnologie , Quelle und Qualitätsstandards der Hilfsstoffe.
13.Experiment Daten und Literatur von Chemische Bestandteile Studie
14.Experiment Daten und Literatur von Qualität Studie
15.Entwurf der Norm von Drogen und die Angabe von Entwurf, Drogen Standard -Stoffe und einsclägigen Informationen
16.Selbst Prüfbericht
17.Experiment Daten und Literatur von Droge Stabilität
18.Grundlage für die Auswahl und Qualität Standard der unmittelbaren Verpackung und Behälter
Pharmakologie und Toxikologie Studieninformationen
19.Zusammenfassung über die Pharmakologie und Toxikologie-Studie Informationen.
20.Experiment Daten und Literatur von Pharmakodynamik
21.Experiment Daten und Literatur von Pharmakologie
22.Experiment Daten und Literatur von akute Toxizität
23.Experiment Daten und Literatur von dauernde Toxizität
24.Spezielle Sicherheitshinweise und Literatur der Überempfindlichkeit (topische, systemische und Foto-Toxizität), hämolytische und topische Stimulieren (Blutgefäß, Haut-, Schleimhaut-und Muskel-) und die Abhängikeit, Reaktion auf lokale und systemische Verwendung der Drogen.
25.Experiment Daten und Literatur von der Genotoxizität
26. Experiment Daten und Literatur von Zeugungtoxizität
27.Experiment Daten und Literatur von Karzinogenität,
28.Experiment Daten und Literatur von Animal Pharmakokinetik Klinik Studieinformation
29.Zusamenfassung der Klinik Studieinformation
30. Pläne und Programme für klinische Studien.
31.Handbuch der Klinikforschung
32Musterentwurf Einwilligungserklärung, Genehmigung der Ethikkommission.
33.Zusammenfassung des Berichts über die klinische Studie
(二)Notizen
1.Angabe der Antrag Information
Zusammenfassende Informationen
1.Information Artikel 1 Name der Arzneimittel
1) Chinesische Name
2) Phonetische Namen
3) Begründung der Benenung
2. Information Artikel 2 Zertifizierte Dokumente
1) Der Nachweis der amtlichen Eintragung der Antragstellenden,Herstellungserlaubnis der Arzneimittel, GMPZertifikate, Kopie von Beglaubigen
2) Zertifizierte Dokumente Angabe Patent-Status und Eigentümer Status von der Technologie, Anwendungszweck und Rezept der Arzneimittel, und die Eklärung , dass es keine Verletzung von Patentrechten der Andere gibt.
3) Kopien der behördlichen Genehmigungen des Forschungsvorhabens von Betäubungsmitteln, psychotropen, medizinisch-Verwendung toxischer und radioaktiver Medikamente
4) Für den Antrag der Produktion neuer Medikamente,soll Kopie der Genehmigung der klinischen Studie der Neu vorgelegt werden.
5) Import Drug Verpackungsmaterial und Container-Zertifikat für die unmittelbare Verpackung und Behälter ( Kopie)
6) Andere Dokumente
Wenn es der Einfuhr ist, werden die folgenden ebenfalls erforderlich:
1) Zertifizierte Dokumente, beglaubigte Dokument der Zulassung für der Arzneimittel Inverkehrbringen, ausgestellt von den zuständigen Behörden des jeweiligen Landes oder Region, wo der Hersteller befindet.Ausfuhrerlaubnis ausgestellt von den zuständigen Behörde
2) Wenn durch ein Agentur in China beantragen, soll die Vollmacht, beglaubigte Dokument und Kopie von Geschäftslizenz des Unternehmens
3) Aus Sicherheitsgründen Experiment Daten sollten Sie GLP-Zertifikat versehen werden GMP-Zertifikat der Proben von klinischen Studien zur Verfügung gestellt werden 3. Information Artikel 3 Grundlage und Anwendungszweck des Thema
Alte und moderne Literatur sollte für TCM und natürliche Arzneimittel zur Verfügung gestellt werden. Quelle der Formel und Grundlage für die Anwendung, aktuelle Entwicklung、 Forschung Situation und Herstellung in China und in Übersee, aktuelle klinische Verwendung und Herstellung Zusammenfassend erforderlichen Analysen für die Innovation, Machbarkeit und Zweckmäßigkeit Darreichungsform, einschließlich der Vergleich mit ähnlichen Medikament bereits mit den nationalen Standard, sollte für die Herstellung von TCM und natürliche Arzneimittel bereitgestellt werden. Für TCM traditionelle medizinische Theorie und alte Droge Buch sollte auch vorgesehen sein.
4.Information Artikel 4 Zusammenfassung und Bewertung der wichtigste Forschungsergebnisse, Schließt Zusammenfassung der wichtigsten Forschungsergebnisse durch den Antragsteller und eine umfassende Analyse der Sicherheit, Wirksamkeit und Qualität Steuerbarkeit der Arzneimittel.
5.Information Artikel 5 Entwurf der Packungsbeilage, Anmerkungen zum Entwurf und neueste Literatur umfasst die Entwurf der Packungsbeilage in Übereinstimmung mit den einschlägigen Vorschriften eingezogen, Notizen, wie die einzelnen Elemente der Packungsbeilage eingezogen worden waren, neuesten relevanten Literatur über die Sicherheit und Wirksamkeit Pharmazeutische Forschung Daten
6. Information Artikel 16 Selbstprüfung beziehen sich auf den Selbsttest Bericht der Probe, Bericht für mindestens einer Charge sollte zum Zeitpunkt der Beantragung der klinischen Studie, nach Abschluss der klinischen Studie, Selbsttest Bericht von der Kontinuierliche drei Chargen bei der Vorlage der Unterlagen. Pharmakologie und Toxikologie Studieninformationen
7. Information Artikel 24 Spezielle Sicherheitshinweise und Literatur der Überempfindlichkeit (topische, systemische und Foto-Toxizität), hämolytische und topische Stimulieren (Blutgefäß, Haut-, Schleimhaut-und Muskel-) und die Abhängikeit, Reaktion auf lokale und systemische Verwendung der Drogen. Experimente Informationen über die Sicherheit der Zubereitung sollte nach den Angaben der Art der Verabreichung und Zubereitung bereitgestellt werden. Wann gibt es eine Tendenz der Drogenabhängigkeit sollte Experiment Daten im Zusammenhang mit der Drogenabhängigkeit zur Verfügung gestellt werden
8. Information Artikel 25 Experiment Daten und Literatur von der Genotoxizität wenn die Medikament Material beinhalten noch nicht in der gesetzlichen Normen Droge gesammelt oder aus dem aktiven Teil der Droge Material noch nicht in der gesetzlichen Normen oder eine neue Droge gesammelt, um Bevölkerung im gebärfähigen Alter, wo sie wirken auf Zeugungssystem verwendet werden (z. als Verhütungsmittel, Sexualhormone, Drogen zum Zwecke der sexuellen Funktionsstörung, die Förderung der Drogen für die Reifung von Spermien, die neuen Medikamente mit positivem Ergebnis im Test Mutationen oder Drogen mit Zytotoxizität), sollte Genotoxizität Testdaten zur Verfügung gestellt.
9. Information Artikel 26 Experiment Daten und Literatur von Zeugungtoxizität
für neue Arzneimittel für die Patienten im gebärfähigen Gruppe, wo er im Bereich der Zeugungssystem wirken können (z. B. Kontrazeptiva, Sexualhormone, Drogen zum Zwecke der sexuellen Funktionsstörung, Drogen für die Reifung der Förderung von Spermien, die neuen Medikamente mit positivem Ergebnis im Test Mutationen oder verwendet werden Medikamente mit Zytotoxizität), sollte Zeugungtoxizität Testdaten nach der spezifischen Situation zur Verfügung gestellt
10. Information Artikel 27 Experiment Daten und Literatur von Karzinogenität,
bei dauernde Toxizität eines neuen Medikaments, wenn zytotoxischen Effekte gezeigt wurden oder außerordentliche Aktivierung auf das Wachstum von Zellen in bestimmten inneren Organen und Geweben verursacht wurden, oder es ist ein positives Testergebnis während Mutagenitätstest, dann Experimente Informationen und Literatur zu Karzinogenität müssen zur Verfügung gestellt.
(二) Anforderungen für Antragsunterlage
1. Information Artikel 1-4 und 7-31 sollten in der Regel zur Anwendung für klinische Studien neuer Medikamente vorgelegt werden.
2. Für Antrag der Arzneimittel Produktion nach Abschluss der klinischen Prüfung, Information Artikel 1-33 sowie sonstige Änderungen sowie zusätzliche Informationen sollten mit ausführlicher Erklärung der Gründe und Grundlagen für den Veränderung vorgelegt werden
3. Information Artikel 2-8, 12 und 15-18 sollten in der Regel für den Einsatz von Generika (außer für TCM oder natürliche Droge Injektion wo klinische Studie ist erforderlich) eingereicht werden.
4. Alle technischen Informationen und beglaubigte Dokument von der lokalen Behörde für die Einfuhrsantrag verwendet werden soll in der chinesischen mit Originaldokument. Chinesische Version von Qualitätsstandards sollten entsprechend dem Format des chinesischen Nationalen Drogen-Standards geordnet und eingereicht werden
5. Wie für die Komplexität und Vielfalt der TCM und natürlichen Drogen, Sollte mit den Eigenschaften bestimmter Sorten der erforderlichen Studien kombiniert werden. Wenn es notwendig Ermäßigung oder Befreiung von Tests,das genügend Gründe gerechtfertigt werden sollte
6. Technischen Anforderungen der TCM und natürliche Droge Injektion gesondert formuliert werden
7. Die erforderlichen Informationen für die unter "Registrierung Kategorie 1" Wirkstoffe und deren Vorbereitung extrahiert aus Pflanzen, Tieren und Mineralien, die nicht in China vermarktet werden, wenn der Wirkstoff oder seine Metaboliten mit den bekannten krebserzeugenden Stoffen oder ähnlichen sind, wenn der erwartete Behandlungsdauer ist länger als 6 Monate, oder die Behandlung der chronisch rezidivierenden Erkrankungen und Intermittierende Gebrauch von Drogen, dann Experimente Informationen und Literatur zu Karzinogenität vorzusehen.
Für die Wirkstoffen und deren Vorbereitung extrahiert aus Pflanzen, Tieren und Mineralien, die in China nicht in den Verkehr gebracht worden, wenn die ähnlich wie Medikament oder eine Zubereitung aus dem aktiven Teil von einzelnen Pflanzen, Tieren und Mineralien gewonnen , die in China vermarktet worden, sind , seiner aktiver Teil sollte mit dem andere über Pharmakodynamik und anderen Aspekten Vergleicht werden,um Vorteilen und Eigenschaften zu zeigen
8. Für den Ersatz der TCM Material unter der Registrierung Kategorie 3, zusätzlich zu den vorklinischen Vorlage Erfordernis der Kategorie 2, soll der Versuch Daten von Pharmakodynamik Vergleich zwischen diesem Medikament und der substituierten Medikament auch vorgesehen werden, Information der menschlichen Toleranz Test-und klinischen Bioäquivalenz Test der damit zusammenhängenden Vorbereitungs sollte auch vorgesehen werden. Wenn der Ersatz ist ein einkomponentiger, Experiment Daten und Literatur der pharmakokinetischen Test vorlegen werden sollen.
Die neue chinesische Kräuter ersetzt genehmigt, die Präparate mit ersetzte Kraüte ,Antrag sollte das Verfahren der ergänzenden Anwendung , aber unbedingt an eine zugelassene Alternative im Bereich der Funktionen beschränkt.
9. Die erforderlichen Informationen für die unter "Registrierung Kategorie 5" Wirkstoffe und deren Vorbereitung extrahiert aus Pflanzen, Tieren und Mineralien, die nicht in China vermarktet werden,zusätzlich zu den erforderlichen Informationen Anwendung, sind auch die folgenden Informationen benötigt, um vorgelegt werden,
1) Forschung Informationen oder Literatur, die Auswahl der aktiven Teile, von Information Artikel 12 erforderlich, Forschungs-Informationen und Literatur zu wichtigen chemischen Inhalt der aktiven Teile von Information Artikel 13 erforderlich.
2) Wenn die aktiven Teile aus mehreren Komponenten besteht, sollte der Gehalt jeder Komponenten untersucht werden, und es sollte untere Grenze der repräsentativen Wert für jede Komponenten (Obergrenze sollte für die toxische Komponente ebenfalls hinzugefügt werden.
3) Bei dem Antrag um neue aktive Teil und deren Vorbereitung, die mit ähnlichem Inhalt zusammengefasst und extrahiert aus Pflanzen, Tieren und Mineralien und nicht in China vermarktet werden, wenn das enthaltende aktiver Teil aus Pflanzen, Tieren und Mineralien extrahiert und in China vermarktet werden, die sollte mit andere über Pharmakodynamik und anderen Aspekten Vergleicht werden,um Vorteilen und Eigenschaften zu zeigen
10. Die erforderlichen Informationen für die unter "Registrierung Kategorie 6", Traditionelle chinesische Medizin, Natürliche Medizin, Ihre Kombinationspräparate in China noch nicht vermarktet für verschiedene Situation sind:
1) Kombinierte Herstellung von TCM, einige Experiment Daten können nach dem Ursprung der Formel, Anzeige-und Herstellungsverfahren befreit werden
2) Experiment Daten und Literatur der Wirksamkeit und der Interaktion mehrerer Komponente sollte für natürlichen Medizin zur Verfügung gestellt
3) Wenn die Rezeptur ehtahltet die Arzneistoffe,die nicht in dem gesetzlichen Arzneimittel -Standard sind,zusätzliche Informationen sind erforderlich, um gemäß den Anforderungen der entsprechenden Eintragung Kategorie eingereicht werden.
4) Es muss eine gesetzliche Standards für jedes Material von Arzneimittel haben, die in der kombinierten Herstellung von TCM, natürliche Drogen und chemische Medikamente eingesetzt.Vergleichsversuch Daten und Literatur im Hinblick auf Wirksamkeit und Interaktion (Verbesserung der Wirksamkeit, Toxizität reduzieren oder Komplimente) zwischen TCM ,natürliche Drogen und chemischen Drogen, sowie Experiment Daten ,die TCM, natürliche Drogen auf die Bioverfügbarkeit von chemischen Drogen, die Beide sollten für die Anwendung von klinischen Studien zur Verfügung gestellt. Bei dem Antrag für die Produktion, Informationen aus klinischen Studie sollte der Nachweis der Notwendigkeit der Rezeptur und die experimentellen Daten der Interaktion in der Bio-Verfügbarkeit zwischen TCM, natürliche Drogen und chemische Medikamente zur Verfügung gestellt werden sollten. Chemische Drogen, die in der Rezeptur(einzeln oder kombiniert Rezepture) verwendet werden, müssen in der National Droge Standards gesammelt wurden.
11. für die unter "Registrierung Kategorie 8", dass das Präparat mit Veränderung der Formulierungen der TCM oder natürliche Drogen bereits in China vermarktet werden, die Vorteile und Vorzüge des neuen Präparat sollte erklärt werden,. Die Indikationen des neuen Präparat sollte grundsätzlich gleiche mit dem alten Präparat ist, wenn es keine Möglichkeit, von der Wirksamkeit oder klinischen Studie zu verifizierung, die entsprechenden Informationen bereitgestellt werden.
12. Für die unter "Registrierung Kategorie 9", sollten Generika mit dem originalen Arzneimittel übereinstimmen, wenn das nötig war, die Qualitätsstandards verbessert werden sollte.
13. Für klinische Studien
1) Fälle von Patienten für klinische Studien sollten den statistischen Bedarf und die erfoderliche minimale Fällen entsprchen
2) Die minimale Fällen erforderlich (Versuchsgruppe) von klinischen Prüfungen sind wie folgt, 20-30 für die Phase I, 100 für die Phase II, 300 für die Phase III, 2000 für die Phase IV
3) Das neue Arzneimittel gehört zu der Kategorie 1, 2, 4, 5 und 6, sowie die Arzneimittel der Kategorie 7 und die Drogen, die bedeutende Änderungen in der Technologie oder des Solvens hat,sollte Phase IV durchgeführt werden.
4) Fälle für Bioverfügbarkeit sollte normal 18-24 sein.
5) Phase I der klinischen Studie des Verhütungsmittel sollten nach dieser Verordnung durchgeführt. In Phase II-Studie sollte eine randomisierte, kontrollierte klinische Studie über mindestens 100 Paare von Probanden für mindestens 6 Zyklen Menstruation durchgeführt werden. In Phase-III-Studie sollte ein offener Prozess auf mindestens 1000 Fällen für 12 Menstruation Zyklen durchgeführt werden. In Phase IV-Studie sollte variable Faktoren diese Drogen sorgfältig geprüft werden, um die Studie mit einer ausreichenden Anzahl von Fällen zu beenden.
6) Die funktionelle Ersatz von neue TCM ersetzte Stoff,sollte TCM aus nationale Drogen-Standard auswählen, die geliche Wirksamkeit wie ersetzte TCM hat, als Vergleiche für vergleichende Studie verwendet, für jede Indikation, sollte mehr als 2 TCM Vorbereitungen für die Überprüfung und klinischen Fällen für jede Zubereitung verwendet werden, sollten nicht weniger als 100 Paaren sein.
7) Für diejenigen, die Veränderung der Formulierungen kann die klinische Prüfung freigestellt werden oder auf nicht weniger als 100 Paare der Fälle nach der Änderung der Verfahren und besondere Eigenschaft der Arzneimittel durchgeführt werden.
8) Für Generika, müssen die klinische Prüfung auf nicht weniger als 100 Paare von Fällen nach bestimmten Situation durchgeführt werden
9) Für importierte TCM oder natürliche Drogen, sollte Antragsunterlagen nach den entsprechenden Anforderungen der Registrierung Kategorie vorgesehen werden, die klinische Daten und Informationen des menschlichen pharmakokinetischen Studie in China durchgeführt vorgesehen sein sollte, mit nicht weniger als 100 Paare von klinischen Fällen. Für mehrere Indikationen, sollten klinische Fälle für jeden wichtigen Indikation nicht weniger als 60 Paare.
三. Tabelle des Antrag Information Artikel und Notizen
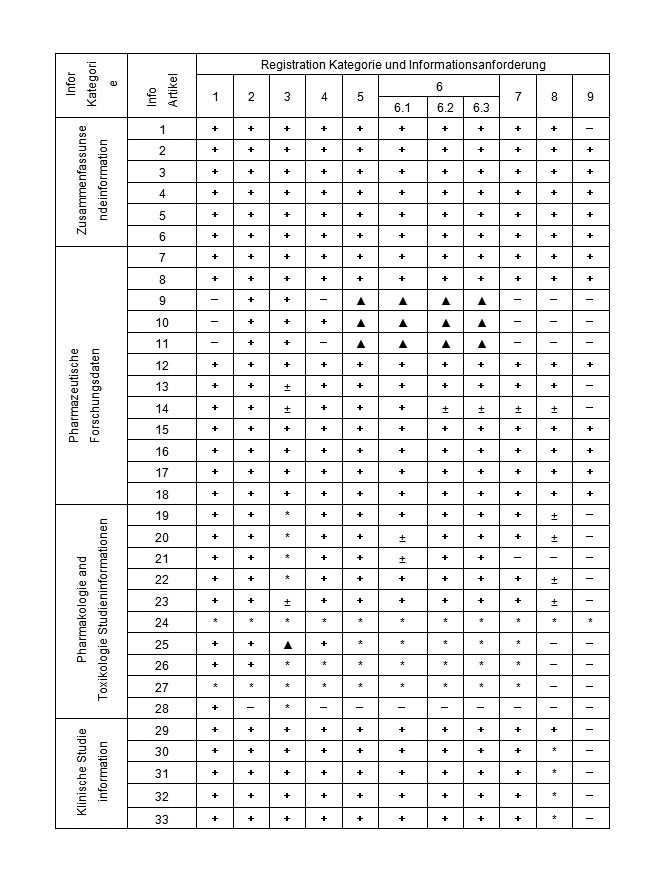
(一) Tabelle des Antrag Information Artikel für TCM und natürlichen Drogen
(二)Notizen
1.“+” Bezeichnen die Informationen müssen eingereicht werden
2.“-” Bezeichnen die Informationen befreit werden können
3.“±” Bezeichnen Literatur kann anstelle der Prüfung Informationen verwendet werden, oder können nach Verordnung freigestellt werden
4.“▲”Wir bezeichnen die Informationen dürfen nicht vorleget werden ,wenn die TCM und natürlicher Arzneimittel in der gesetzlichen Normen sind, und wenn nicht aufgeführt ist, Daten vorzulegen
5.“*” Die Angaben entsprechend der Anforderung vorgelegt werden